En un pasillo tranquilo en el último piso de un edificio de la Universidad de Osaka en Japón, Katsuhiko Hayashi está tramando una revolución.
Ciencia de embriones humanos: ¿podrán los reguladores del mundo seguir el ritmo?
Él está en una búsqueda de décadas para cultivar óvulos y espermatozoides en el laboratorio. Hayashi quiere comprender la biología fundamental de estas células reproductivas. Pero, si lo logra, podría alterar para siempre. cómo se reproducen los humanos.
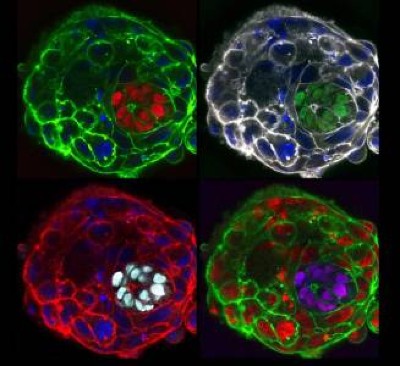
Incluso para un científico conocido por su extrema obstinación, ha sido un camino tortuoso. Ha llevado a Hayashi a lugares extraños: su laboratorio crece fragmentos de ovarios falsos y testículos en platos y ha producido ratones con dos padres y ninguna madre1.
Cada artículo que publica trae correos electrónicos de personas que claman por ayudar con su fertilidad. «Les digo: 'Esto todavía es experimental'», dice Hayashi. «Pero a veces no puedo responder. Hay demasiados».
El trabajo que están haciendo Hayashi y otros en el campo podría ofrecer nuevas esperanzas a las personas que luchan contra la infertilidad y a las parejas del mismo sexo que quieren tener hijos genéticamente relacionados con ambos miembros de la pareja. Pero a pesar de los resultados deslumbrantes que los investigadores han logrado en roedores, ese futuro sigue siendo lejano. «La tecnología es genial», dice Christian Kramme, director científico de Gameto, una empresa de biotecnología centrada en la fertilidad en Austin, Texas. «Pero fundamentalmente, no creo que haya una sola persona en el mundo que deba intentar implementar esto clínicamente en la próxima década».
Sin embargo, hay muchos objetivos provisionales que los investigadores deben perseguir. Las compañías farmacéuticas y los reguladores esperan que un suministro abundante de gametos humanos (el término colectivo para los óvulos y los espermatozoides) pueda facilitar la prueba de si los medicamentos y otros compuestos podrían reducir la fertilidad o causar mutaciones que se transmitirían a la siguiente generación, dice Ina Dobrinski, bióloga reproductiva de la Universidad de Calgary en Canadá.
Y aprender a recapitular el desarrollo humano en el laboratorio podría revelar pistas sobre la infertilidad, afirma Azim Surani, biólogo del desarrollo de la Universidad de Cambridge, Reino Unido. «Éste será el mayor resultado de estos estudios», afirma. «Una vez que comprenda las causas de la infertilidad, podrá encontrar formas de superarla».
Pero a medida que los laboratorios avanzan con estos experimentos, algunos investigadores expresan su preocupación sobre los posibles usos futuros de la tecnología. El cultivo de grandes cantidades de gametos en el laboratorio podría facilitar a los padres la selección de embriones con características deseables e incluso facilitar la generación de bebés genéticamente modificados.
Aunque, según algunas estimaciones, faltan al menos 15 años para tales usos, los investigadores y algunos organismos gubernamentales están pidiendo regulaciones para abordar los problemas potenciales asociados con los óvulos y el esperma cultivados en laboratorio, un proceso conocido como in vitro gametogénesis (IVG).
Los investigadores difieren en sus estimaciones sobre cuándo se hará realidad la IVG en humanos. El laboratorio de Hayashi ha producido crías de ratón fértiles a partir de lo que él llama células parecidas a huevos cultivadas en el laboratorio.2. Existe la posibilidad de que en los próximos dos años se puedan producir equivalentes humanos de estas células en un laboratorio, afirma.

Estos ratones tienen dos padres biológicamente masculinos. Fueron generados utilizando óvulos elaborados a partir de células de la piel de los machos.Crédito: Katsuhiko Hayashi, Universidad de Osaka
Pero eso no significa que estarán listos para su uso en personas, añade. Sólo una pequeña proporción de los embriones de ratón generados a partir de sus células parecidas a óvulos dan lugar a crías vivas, y Hayashi especula que podrían ser necesarios cinco años o más para producir óvulos humanos verdaderamente funcionales con tasas de éxito aceptables.
Los científicos también necesitarán desarrollar y probar gametos de primates no humanos. Idealmente, la descendencia generada a partir de estos óvulos y espermatozoides sería rastreada durante varias generaciones, añadiendo años a la línea de tiempo. «Ese es un punto crítico», dice Mitinori Saitou, biólogo del desarrollo de la Universidad de Kyoto en Japón. «Mi conjetura es que probablemente tendremos que confiar en nuestra próxima generación de científicos para esto».
Una receta para gametos
Durante casi 20 años, los investigadores han sabido cómo reprogramar células del cuerpo humano en células madre pluripotentes inducidas (iPS), que pueden adoptar casi cualquier identidad celular. Estas células se han utilizado para producir células cardíacas que laten al unísono y células nerviosas que conducen señales eléctricas. Pero recapitular el complejo y prolongado desarrollo de los espermatozoides y los óvulos ha resultado ser más difícil. «Hay muchas etapas involucradas», dice Surani. «Y cada uno de ellos es muy complejo».
Normalmente, la gametogénesis comienza mucho antes del nacimiento. El desarrollo de los óvulos comienza en el feto, en el que se producen millones de óvulos inmaduros. Algunas de estas células inician luego una forma especializada de división, llamada meiosis, en la que pierden un conjunto de cromosomas y cada célula conserva la mitad del número de una célula normal. Pero esta división tarda años en completarse: las células hacen una pausa a mitad de la meiosis y no se reanudarán hasta años más tarde, después de la pubertad, cuando ovulan. Cada óvulo inmaduro está rodeado de tejido que forma un folículo lleno de líquido. Estos folículos secretan hormonas y maduran a medida que se desarrolla el óvulo.
Mientras tanto, las células que dan lugar a los espermatozoides también se forman en el feto y, después de la pubertad, pueden producir millones de espermatozoides cada día en los sinuosos túbulos seminíferos de los testículos. Su entorno tubular es más complejo que el de los folículos del ovario y más difícil de recapitular para los científicos en el laboratorio.
En ambos casos, el entorno en el que se desarrolla el óvulo o el espermatozoide es crucial. Las células se comunican con su entorno a través de proteínas y otras moléculas, y reciben señales físicas de su entorno que influyen en su desarrollo.
Los espermatozoides inmaduros parecen responder al flujo de líquido que los rodea a medida que avanza a través de los túbulos de los testículos, dice Hayashi. Y la rigidez de los tejidos de un ovario ayuda a mantener detenido el óvulo en desarrollo, dice Evelyn Telfer, bióloga reproductiva de la Universidad de Edimburgo, Reino Unido.
Las polémicas pruebas con embriones que prometen un mejor bebé
Estas señales y andamios son difíciles de replicar en el laboratorio, especialmente para la IVG humana, porque es muy difícil obtener tejido para estudiar el desarrollo normal de los ovarios y los testículos. Los investigadores están utilizando técnicas que les permiten monitorear la actividad genética y la expresión de proteínas en células individuales y en tejido intacto, para identificar qué moléculas y tipos de células podrían ser importantes, dice Chuva de Sousa Lopes, bióloga del desarrollo del Centro Médico de la Universidad de Leiden en los Países Bajos.
Algunos estudios incuban células humanas con células de ovario o testículos de ratón para estimularlas a convertirse en óvulos y espermatozoides.3. Pero este enfoque no puede no utilizarse para producir gametos destinados a la reproducción humana debido a una posible contaminación con virus animales.
En la Universidad de Columbia Británica en Vancouver, Canadá, el urólogo Ryan Flannigan y sus colegas están imprimiendo en 3D túbulos testiculares a partir de células humanas para sus experimentos de IVG.4. Otros enfoques incluyen el uso de dispositivos de microfluidos diseñados para imitar los órganos. El laboratorio de Dobrinski cultiva cultivos de células tridimensionales llamados organoides, que combinan varios tipos de células que se encuentran en los testículos.
Todavía quedan problemas por resolver. El equipo de Dobrinski, por ejemplo, lucha por mantener vivos sus organoides durante el tiempo suficiente para desarrollar gametos humanos. En humanos, el desarrollo de óvulos y espermatozoides lleva meses3sin contar los años de espera hasta la pubertad, dice Kotaro Sasaki, biólogo reproductivo de la Universidad de Pensilvania en Filadelfia. «Mucha gente no sabe lo difícil que es», afirma.
Gametos en marcha
Ese largo tiempo en cultivo no sólo ralentiza la investigación, sino que también puede aumentar el riesgo de que algo salga mal, comprometiendo potencialmente la salud del producto final y de cualquier descendencia, dice Eishi Aizawa, biólogo del desarrollo de la Universidad de Harvard en Cambridge, Massachusetts.
Algunos grupos están intentando hacer que el proceso sea más eficiente. Por ejemplo, un equipo encontró recientemente tres proteínas y cada una parece capaz de iniciar la meiosis en células iPS tanto masculinas como femeninas.5.
Pero algunas características de esta meiosis son inusuales y las células no completan su división, dice el miembro del equipo Merrick Pierson Smela, director científico de Ovelle, una empresa de biotecnología en Boston, Massachusetts.
La meiosis es un obstáculo clave para la IVG, dice Paula Cohen, bióloga celular de la Facultad de Medicina Veterinaria de la Universidad de Cornell en Ithaca, Nueva York. Ella y sus colaboradores han estado tratando de convencer a gametos humanos inmaduros para que se sometan a una meiosis normal durante aproximadamente una década. «No funciona», dice. Cohen dice que muchos de los equipos que han tenido éxito no han demostrado completamente que la meiosis se produce en sus placas de Petri como lo haría en el cuerpo. Y una meiosis adecuada es importante: los errores en el proceso pueden dar lugar a gametos con un número incorrecto de cromosomas.
Un enfoque diferente, informado el mes pasado6parece producir óvulos funcionales capaces de ser fertilizados. Los investigadores reemplazaron el núcleo de un óvulo inmaduro, que tiene una copia de cada cromosoma, por el núcleo de una célula de la piel, que contiene dos de cada cromosoma. Luego desencadenaron un proceso, al que llamaron mitomeiosis, que descartaba un conjunto de cromosomas, imitando algunas características de la meiosis.
Alrededor del 9% de estas células dieron lugar a óvulos viables que fueron fertilizados y desarrollados durante otros seis días, generando un precursor de un embrión conocido como blastocisto. Pero todos los blastocistos tenían anomalías cromosómicas y no sufrieron el cambio genético que suele tener lugar durante el desarrollo de los gametos. Esta recombinación es una fuente de diversidad genética y no está claro cómo su falta afectaría a la descendencia, dice Cohen, o cómo el proceso de mitomeiosis afecta las divisiones celulares posteriores. «Esto debería estudiarse intensamente».
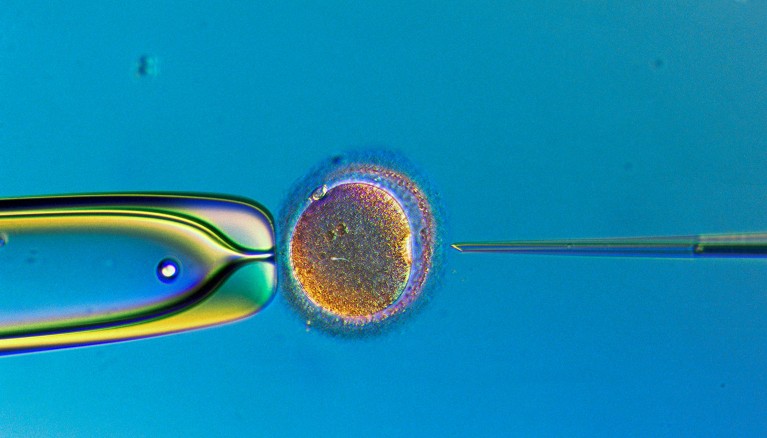
Los gametos cultivados en laboratorio algún día podrían usarse para in vitro fertilización.Crédito: Lennart Nilsson, TT/Science Photo Library
Otro obstáculo para lograr la IVG humana es recrear la compleja secuencia de alteraciones del ADN que ocurren en las diferentes etapas del desarrollo. Al comienzo de la gametogénesis, las células borran sistemáticamente ciertas modificaciones químicas que pueden afectar la actividad genética; más tarde, se añaden nuevas modificaciones a determinadas regiones del ADN, algunas de las cuales se dice que están «impresas».
Este paso es crucial: más de una docena de trastornos se han relacionado con una impronta inadecuada, afirma Surani. «Hay que hacerlo bien», dice.